- 海外製化学品の調達なら重松貿易 HOME>
- 注目製品・サービス特集一覧>
- <融合タンパク解析に!>Genovis社GlySERIAS
<融合タンパク解析に!>Genovis社GlySERIAS

GlySERIASの特徴
GlySERIASは、Gly(4)SerやGly(x)Ser(y)(GS)、ポリグリシンリンカーなどのグリシンに富んだ柔軟な融合タンパク向けリンカーを切断するユニークな酵素です。
この酵素により、融合タンパクのドメインが切り離され、特性解析が容易になります。融合タンパクの中間レベルの解析は、サンプル全体の複雑さを軽減すると同時に、ドメイン固有の検証や翻訳後修飾のモニタリングを可能にする役割を果たします。なお、GlySERIASは凍結乾燥品の酵素として提供され、2mgまでの融合タンパクを処理することが可能です。
利用例1:GSリンカーを有する融合タンパク(デュラグルチド)の切断
融合タンパクであるデュラグルチドは、2つのグルカゴン様ペプチド-1 (GLP-1) 分子が、GSリンカーを介してヒトIgG4のFc領域と結合したものです。ペプチドとFc領域を個別に解析し、特定の翻訳後修飾(PTM)を同定できるように、デュラグルチドをGlySERIASで37℃、1時間という条件で消化しました。さらに、サンプルの複雑さを軽減するために、エンドグリコシダーゼであるGlycINATORを用いてFc領域の糖鎖を除去し、鎖間ジスルフィド結合をDTTで還元しました (Fig. 1a).
逆相LC-MSによる分析では、GlySERIASを用いたリンカー切断により、Fc領域からGLP-1ペプチドが完全に除去されていることが確認されました。リンカーには多数のグリシン残基が存在するため、GlySERIASの切断部位は多岐にわたり、そのためFc/2およびGLP-1ペプチドは、グリシンおよびセリン残基の数が異なる複数のバリアントとして検出されました(Fig. 1b, c)。GLP-1は、グリシン残基がそれぞれ4個と5個の2つのバリアントとして存在を確認しました。また、GLP-1ペプチドには酸化修飾が確認されました。Fc/2サブユニットは、3つの主要なバリアントとして存在を確認しました。それはセリン残基が1つ残ったFc/2、SG3リンカーを持つFc/2、SG4Sリンカーを持つFc/2です。GlySERIASが複数の部位を同時に消化したにもかかわらず(Fig. 1d)、得られた異なるFc/2バリアントの相対量において、3度の切断実験は再現性のある結果を示しました(Fig. 1e)。
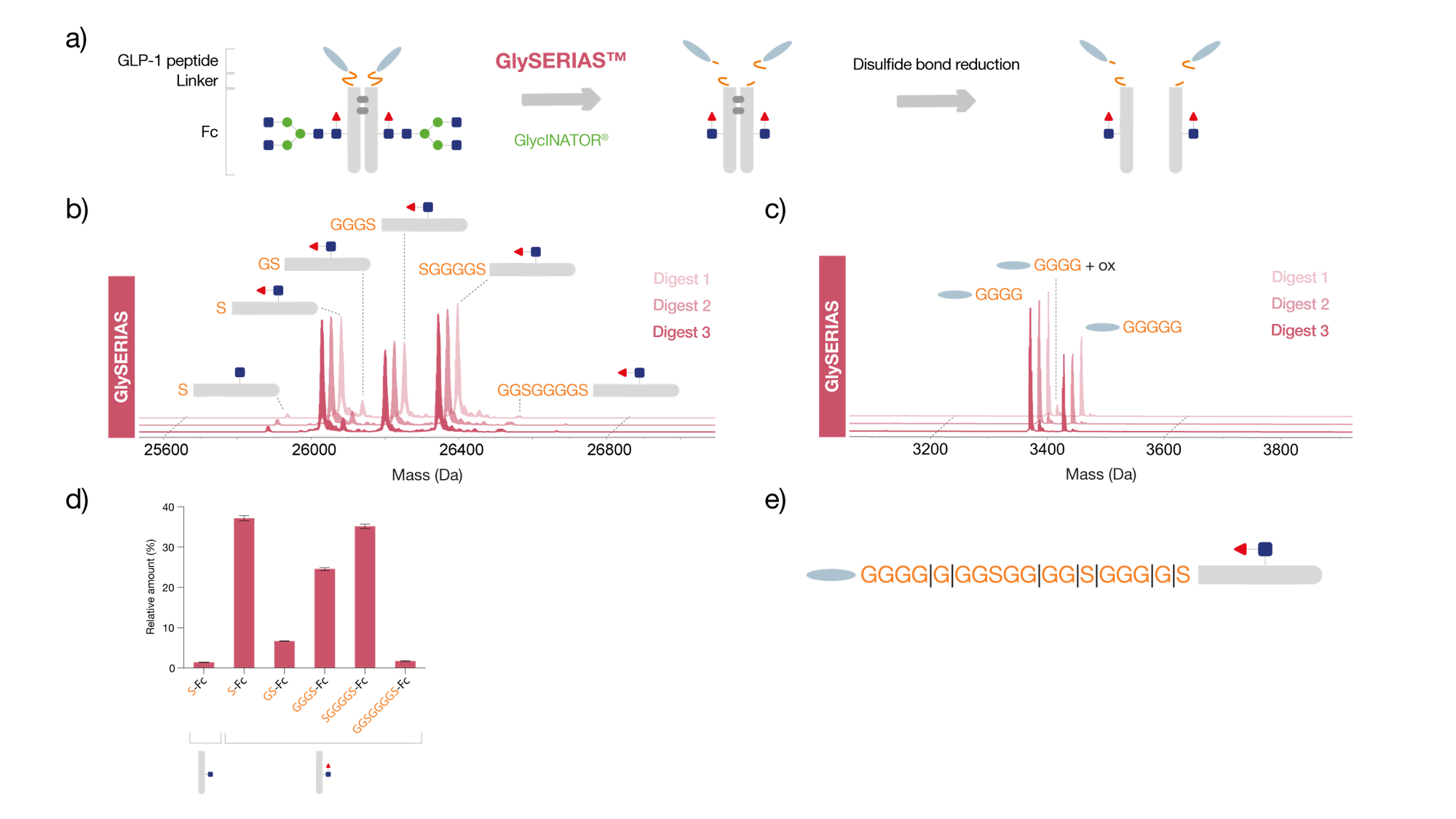 Figure 1. Digestion of dulaglutide using GlySERIAS.
Figure 1. Digestion of dulaglutide using GlySERIAS. The flexible GS linker of dulaglutide was digested with GlySERIAS for 1 hour at 37°C under native conditions, and the Fc glycans were concurrently hydrolyzed using GlycINATOR to reduce sample complexity. To stop the GlySERIAS reaction, 1 mM ZnCl2 was added. The interchain disulfide bonds were reduced with 20 mM DTT for 30 minutes at 37°C. The digest was performed in triplicate. a) Illustration of the sample preparation workflow. The samples were analyzed by reversed-phase LC-MS. b) Deconvoluted mass spectrum of the Fc/2 subunit. c) Deconvoluted mass spectrum of the GLP-1 peptide. d) Relative amount of the identified Fc/2 variants, displaying the mean value between the triplicate digests and error bars representing the standard deviation. The digestion products were separated by reversed-phase chromatography (BioResolve™ RP mAb Polyphenyl, 450 Å, 2.7 µm 2.1 x 100 mm, Waters™) and analyzed with ESI-QTOF MS (Bruker Impact II). e) Schematic image of the flexible linker, connecting the GLP-1 peptide to the Fc/2 subunit, and the identified digestion sites.
利用例2:ポリグリシンリンカー有する融合タンパク(ロミプロスチム)の切断
ロミプロスチムは、4つの同一のトロンボポエチン(TPO)受容体結合ペプチドと1つのヒトIgG1 Fc領域からなり、ポリグリシン配列によって結合されています。このタンパク質を37℃で1時間および一晩、GlySERIASで消化し、鎖間ジスルフィド結合をDTTで還元しました(Fig.2a)。1時間の消化の後、1つのTPOペプチドのみが結合した少量のFc/2が確認されました(Fig. 2b)。これにより、2つ目のTPOペプチドの干渉がなくなり、Fc/2と1つ目のTPOペプチドとの間のリンカー領域を研究することが可能となりました。しかしながら、大部分は、両方のTPOペプチドがFc/2から切断され、4つのグリシン残基を有するFc/2と1〜7つのグリシン残基を有するTPOペプチドが主な消化産物として確認できました(Fig. 2c)。オーバーナイトによる消化により、より均質なサンプルが得られ、TPOペプチドは両方ともFc/2サブユニットから完全に切り離されました。得られたペプチドは、それぞれ1〜5個のグリシン残基を含んでいました。このワークフローは、GlySERIAS が融合タンパクのポリグリシンリンカーの分析に利用でき、また、複数のドメインが結合した融合タンパクを消化して、個々のドメインをより詳細に分析できることを示しています (Fig. 2d)。
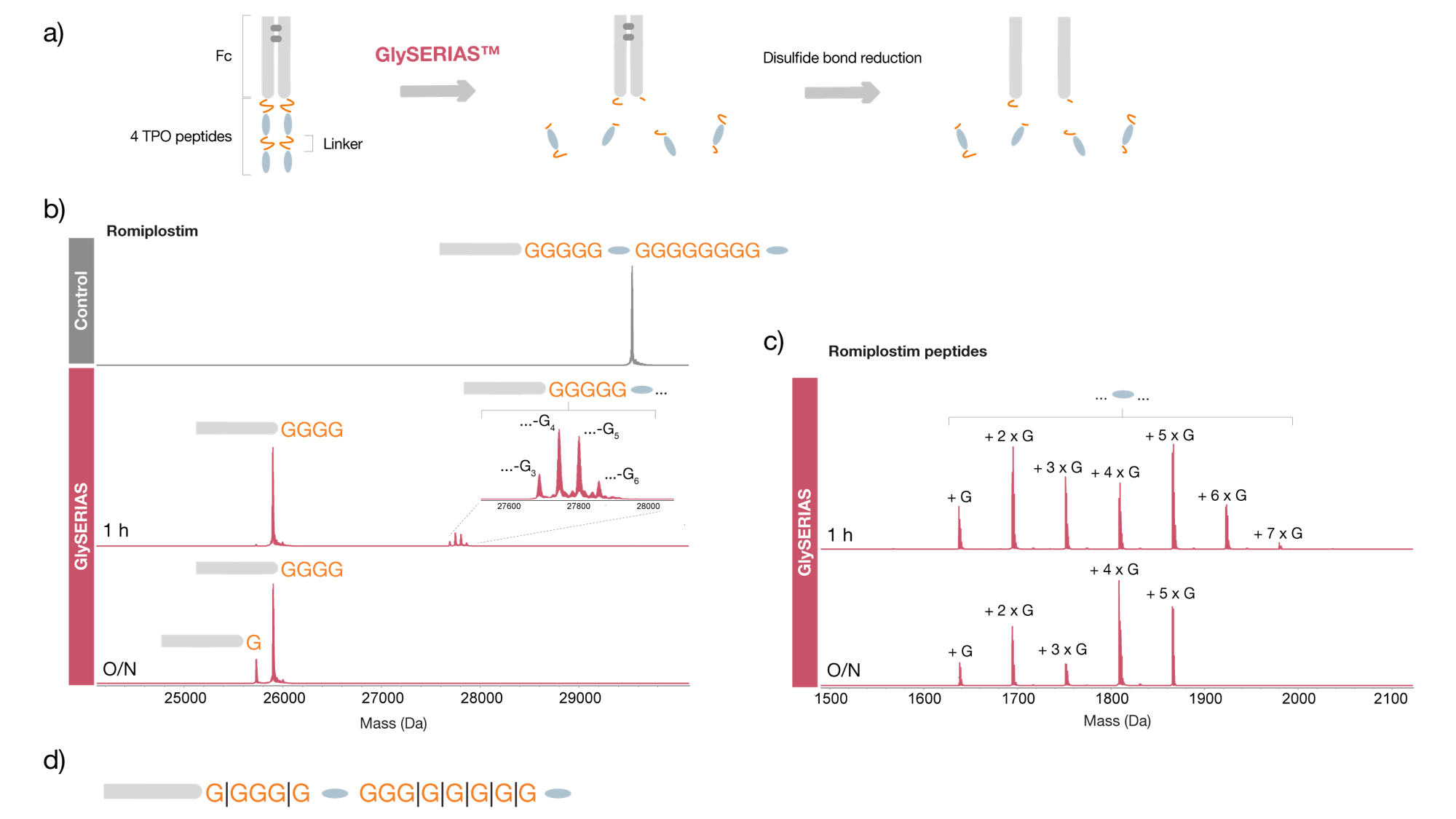 Figure 2. Digestion of romiplostim using GlySERIAS.
Figure 2. Digestion of romiplostim using GlySERIAS. The polyglycine linkers of romiplostim were digested with GlySERIAS for 1 hour and overnight at 37°C under native conditions. The interchain disulfide bonds were reduced with 20 mM DTT for 30 minutes at 37°C. a) Illustration of the sample preparation workflow. The samples were analyzed by reversed-phase LC-MS. b) Deconvoluted mass spectrum of the Fc/2 subunit. c) Deconvoluted mass spectrum of the TPO receptor binding peptide. The glycine residues can be present at both ends of the peptide. The digestion products were separated by reversed-phase chromatography (BioResolve™ RP mAb Polyphenyl, 450 Å, 2.7 µm 2.1 x 100 mm, Waters™) and analyzed with ESI-QTOF MS (Bruker Impact II). d) Schematic image of the two flexible linkers, connecting first the Fc/2 subunit to one TPO receptor binding peptide and then to the second TPO receptor binding peptide, and the identified digestion sites.
製品リスト
GlySERIASは凍結乾燥品の酵素として提供され、2mgまでの融合タンパクを処理することが可能です。
- 製品の詳細はこちらです-> https://www.genovis.com/products/glyserias/
- プロダクトシート-> https://www.genovis.com/wp-content/uploads/instructions-glyserias.pdf
- Genovis社総合カタログ-> Genovis_2021-22製品カタログ日本語版
- Genovis社関連記事一覧-> https://www.shigematsu-bio.com/?s=Genovis
関連記事
お気軽にご相談・お問い合わせください。
お電話でのお問い合わせ
- 大阪本社06-6231-6146
- つくばオフィス029-848-3220
FAXでのお問い合わせ
- 大阪本社06-6231-6149
- つくばオフィス029-848-3221